Uno de los pilares de este nuevo marco regulatorio fue la serialización de medicamentos, un nuevo sistema que permite verificar la autenticidad de cada envase a través de un Identificador Único (UI) y la inclusión de un Dispositivo Contra Manipulaciones (DCM), también conocido como Anti-Tampering Device (ATD). Estos mecanismos de verificación son esenciales para detectar medicamentos falsificados y asegurar su trazabilidad a lo largo de la cadena de suministro.
La entidad encargada de coordinar el sistema de verificación a nivel europeo es EMVO (European Medicines Verification Organisation) y lo hace a través de una plataforma común, la plataforma EMVS (European Medicines Verification System). Esta plataforma conecta a todos los países miembros, haciendo posible una verificación uniforme de los medicamentos en toda la Unión Europea.
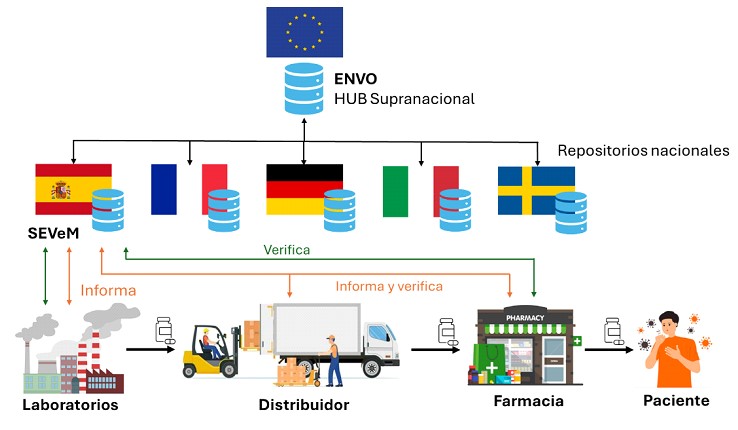
En España, la implementación del sistema fue liderada por SEVeM (Sistema Español de Verificación de Medicamentos), cuya función principal es la de garantizar la trazabilidad y verificación de los medicamentos en el ámbito nacional. Como parte integral del sistema europeo, SEVeM ha jugado un papel fundamental en el fortalecimiento de la seguridad del sistema de salud español.
A pesar de que la puesta en marcha de este nuevo sistema de serialización haya logrado importantes avances, su implementación fue un proceso desafiante para toda la industria farmacéutica. Los sistemas locales necesitaron adaptarse a los estándares europeos, lo que generó grandes desafíos. Algunos de los más relevantes fueron:
-
- Tecnológicos: durante los primeros meses surgieron problemas relacionados con la interoperabilidad, especialmente en el escaneo de los códigos de producto.
-
- Capacitación del personal: fue necesaria una formación intensiva para todo el personal involucrado en la cadena de suministro farmacéutica, desde los laboratorios hasta las oficinas de farmacia, para garantizar la correcta utilización de las nuevas herramientas de verificación y el cumplimiento de las normativas europeas.
-
- Impacto económico: la inversión inicial en infraestructuras tecnológicas, tanto a nivel local como europeo, fue considerable.
Pero no todo ha sido malo, la implementación de estos mecanismos ha sido clave para lograr la estabilidad del sistema y ha permitido otros muchos avances que eran necesarios desde hacía tiempo:
-
- Optimización tecnológica: el Portal EMVO se ha ido sometiendo a actualizaciones periódicas, alcanzando la optimización y asegurando la trazabilidad para toda la UE.
-
- Mayor integración: la mayoría los agentes de la cadena de suministro están conectados al Sistema de Serialización. Actualmente en España están conectados a SEVeM:
-
- 213 Hospitales
-
- 42 Oficinas de Farmacia Militares
-
- 340 Almacenes de Distribución Mayorista Farmacéutica
-
- 22.220 Oficinas de Farmacia
-
- 555 Laboratorios TACs
-
- Mayor integración: la mayoría los agentes de la cadena de suministro están conectados al Sistema de Serialización. Actualmente en España están conectados a SEVeM:
-
- Reducción de alertas: uno de los logros más destacados ha sido la notable reducción de alertas técnicas. Durante los primeros meses de implementación, el 20,34% de la actividad semanal de serialización generaba alertas. Sin embargo, en la semana del 23 al 29 de septiembre de 2024, este porcentaje se redujo al 0,036%, cumpliendo con el objetivo de la Unión Europea de mantener las alertas por debajo del 0,05% de todas las transacciones realizadas.
Tras casi cinco años de implementación, y de una constante mejora y optimización del sistema a nivel nacional, se consiguió alcanzar la estabilización del sistema de verificación en España.
Desde el 30 de septiembre de 2024, la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) no permite suministrar o dispensar cualquier medicamento que genere una alerta en el sistema y del que no se pueda descartar una sospecha de falsificación conforme a lo establecido en el Reglamento Delegado (UE) 2016/161 de la Comisión. La AEMPS también mantiene actualizadas las instrucciones para los laboratorios farmacéuticos, distribuidores y oficinas de farmacia sobre cómo gestionar y notificar las sospechas de falsificación, asegurando así la protección de los pacientes.
Para gestionar las alertas de manera más eficiente, en 2023 EMVO desarrolló el European Alert Management System (EAMS), un sistema diseñado para permitir a las organizaciones abordar rápidamente cualquier alerta con menos costes operativos. Este sistema ha ido evolucionando, con mejoras en la funcionalidad, como la gestión de usuarios, la visualización de alertas y la capacidad de realizar cambios en masa.
A nivel europeo, el portal AMS (Alert Management System) es parte integral de la estrategia para estandarizar la gestión de alertas en todos los países europeos. Por su parte, SEVeM, en España, prevé estar conectado al Sistema de Gestión de alertas Europeos (EAMS) para enero de 2025. A partir de ese momento SEVeM habrá cumplido otro hito en la estabilización de las alertas en España, ya que los Laboratorios conectados a la EAMS ya no tendrán que enviar a SEVeM los informes de análisis de alertas, si no que podrán gestionar sus alertas directamente a través del EAMS.
Aunque la implementación de la serialización de medicamentos en España ha sido un proceso desafiante, los avances conseguidos hasta la fecha son significativos. La integración exitosa del sistema de verificación, la reducción de alertas y la estabilización del sistema en general demuestran la efectividad de las medidas adoptadas. A medida que SEVeM y los sistemas nacionales continúan mejorando la funcionalidad y la interoperabilidad del sistema, se fortalecerá aún más la lucha contra la falsificación de medicamentos, garantizando la seguridad de los pacientes en España y en toda la Unión Europea.
La experiencia de España, dentro del contexto europeo, refuerza la importancia de trabajar en una red unificada para combatir un problema global.